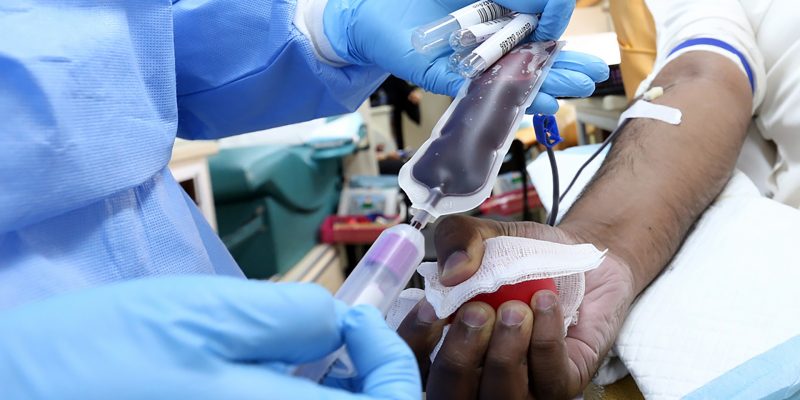
Si bien parte de la actual estrategia para enfrentar el virus es cortar la cadena de contagio con una correcto testeo, trazabilidad y aislamiento, también expertos trabajan en generar terapias o tratamientos para quienes se contagian del SARS-CoV2 y agravan.
Es el caso del uso del plasma convaleciente, que a lo largo del tiempo ha recibido apoyo y elogio de expertos, instituciones de salud, autoridades y celebridades, pero que aún no existen estudios suficientes para demostrar su real efectividad. Este tratamiento hoy suma un nuevo antecedente: La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) dio pie atrás en la aprobación de emergencia del plasma convaleciente en tratamientos de pacientes con COVID-19.
A ese aspecto, señaló a Futuro 360 el director técnico de la Red de Medicina Transfusional de RedSalud, Dr. Marcelo Díaz de Valdés, que “la terapia con plasma convaleciente sigue aún siendo una terapia experimental y necesitamos aún saber a quiénes transfundir, qué dosis y en qué momento”.
A ello el profesional, que es parte de los centros incluidos en un estudio que la Fundación Arturo López Pérez (FALP), agregó que “su eficacia aún se encuentra en desarrollo y se está comparando con pacientes controles, es decir, pacientes que teniendo los mismos criterios de edad, gravedad, igual tratamiento farmacológico y riesgos asociados y que no se transfundieron”.
En tanto, la investigadora del Centro de Envejecimiento y Regeneración (Care UC) y del Centro de Excelencia en Biomedicina de Magallanes (Cebima), Dra. Daniela Rebolledo agregó que “todavía no se sabe o no queda claro si es que en realidad no hubieran usado ese plasma, si se hubieran mejorado en el mismo tiempo o si hubiera sido más lento”.

Según publicó The New York Times un grupo de altos funcionarios de salud que incluye al Dr. Francis S. Collins y el Dr. Anthony S. Fauci intervino afirmando que datos conocidos sobre el tratamiento eran débiles. Aún así, se podría emitir una aprobación de emergencia en el futuro.
La autorización que iba a entregar la FDA se basó en el historial del uso del plasma en otros brotes de enfermedad, en la investigación con animales y una serie de estudios que incluyeron el de la Clínica Mayo que involucró a más de 66.000 pacientes con COVID-19.
Leer también: Uso de plasma convalenciente en COVID-19: ¿En qué consiste la terapia que la FDA permitirá su uso?
Según detalla el medio, la autorización de emergencia que entrega la FDA no requiere el mismo nivel de evidencia que una completa. Anteriormente, permitieron esto con la hidroxicloroquina y cloroquina, pero luego tuvieron que revocar la aprobación debido a que se descubrió ineficacia y posibles daños que pudiera generar.
El aumento de pacientes que buscan ser parte de este tratamiento en la clínica Mayo ha generado un debate entre los investigadores respecto a la certeza empírica para aprobar el uso en pacientes frente a una emergencia sanitaria.
“Una aprobación de emergencia cambiaría la forma en que las personas ven los ensayos”, señaló a The New York Times la Dra. Mila B. Ortigoza, especialista en enfermedades infecciosas en NYU Langone Health. “Queremos asegurarnos que cuando decimos que funciona, tenemos confianza, con evidencia indiscutible. Aquí estamos lidiando con la vida de pacientes”, agregó.

Detalles de algunos estudios preliminares
En resultados preliminares de un reciente estudio – que aún no es revisado por pares – que involucró a más de 35.000 pacientes con COVID-19, se detalló que el tratamiento al ser administrado tres días posterior al diagnóstico permitió reducir las tasas de mortalidad en pacientes críticos.
Al revisar la administración un mes después, afirman que la tasa de muertes que recibieron el plasma tres días después del diagnóstico tuvieron una tasa de muerte a los siete días del 8,7%, mientras que los pacientes tratados cuatro o más días después tuvieron una tasa de mortalidad del 11,9%.
El detalle, según el medio estadounidense, es que este estudio no contó con un grupo de control de pacientes que recibió un placebo que se pudiera comparar con los que recibieron plasma, lo que provoca dificultades para saber si realmente funcionó. Además, señalan poca viabilidad de administrar el tratamiento tres días posterior al diagnóstico.
Por otra parte, un equipo de investigación de los hospitales Metodistas de Houston publicó resultados preliminares de la administración a pacientes hospitalizados con COVID-19 en el American Journal of Pathology. En este se detalló que los 136 pacientes que recibieron tratamiento con plasma convaleciente tenías más probabilidades de sobrevivir cuatro semanas después, en comparación con 251 pacientes que no lo recibieron. Para esto se consideró su uso dentro de los tres días posteriores al ingreso al hospital.

En tanto, durante julio un equipo de investigadores de los Países Bajo detuvo sus ensayos tras evidenciar que los pacientes que recibieron plasma no mostraron diferencias en la mortalidad. Según señalaron quienes fueron tratados con esto, ya habían desarrollado sus propios anticuerpos.
“Aún no se ha demostrado que el plasma convaleciente funcione con los ensayos que queremos ver, estos ensayos de control aleatorios”, señaló a CNN en Español el Dr. Ian Lipkin, director del Centro de Infección e Inmunidad de la Escuela de Salud Pública Mailman de la Universidad de Columbia.
A lo anterior agregó que “aunque allí también hay muchas razones para el optimismo, no se ha demostrado y hasta que se haga, siempre habrá un escepticismo saludable en la comunidad, a pesar de toda la información de fondo que sugiere que es probable que funcione”.


Deja tu comentario